下拉刷新...
福建医科大学联合培养博士研究生在《Neuron》上发表研究成果!
近日,福建医科大学与中国科学院脑科学与智能技术卓越创新中心联合培养的2023级博士研究生黄雪晶以第一作者在神经科学期刊《Neuron》上发表重要研究成果《镁离子对NMDA受体多重调控机制的结构基础》。此项成果是中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)和福建医科大学合作共同完成的。中科院脑智中心的竺淑佳研究员和学校陈万金教授为共同通讯作者。

Mg2+是神经系统中一种重要的二价阳离子,广泛参与神经发育、突触可塑性以及体内稳态的维持,其胞外浓度约为1 mM。Mg2+最为人熟知的功能之一是作为NMDA受体的电压依赖性阻断剂,在静息膜电位下,Mg2+会结合NMDA受体并阻断其电流;当膜电位去极化时,这种阻断作用会被解除。这种双信号协同调控机制,使NMDA受体能够作为突触可塑性的“coincidence detector”,在突触前神经递质释放与突触后去极化同步发生时才被激活,进而触发Ca2+依赖的胞内信号级联反应。这一特性奠定了NMDA受体在学习记忆、长时程增强及神经发育中的核心地位。
然而,由于Mg2+离子半径小,冷冻电镜的分辨率不足以清晰捕捉其结合位点。Mg2+在NMDA受体中的具体结合位点及其调控机制,以及Mg2+阻断而Ca2+通透的结构基础,一直未得到全面解析。研究团队通过整合单颗粒冷冻电镜、电压钳记录和分子动力学模拟等技术,系统揭示了Mg2+在NMDA受体中的多重作用机制,发现存在三个独立的Mg2+结合位点:位点Ⅰ位于选择性过滤器上——由天冬酰胺形成的环形结构,通过配位键与Mg2+结合,负责经典的电压依赖性阻断功能。位点Ⅱ和Ⅲ则位于GluN2B亚基的N端结构域(NTD),分别介导Mg2+的变构增强与抑制作用(图1)。该工作还诠释了Mg2+阻断和Ca2+通透的差异性分子机制。为理解NMDA受体在兴奋性突触传递中的功能及其在突触可塑性中的作用提供了新的视角。
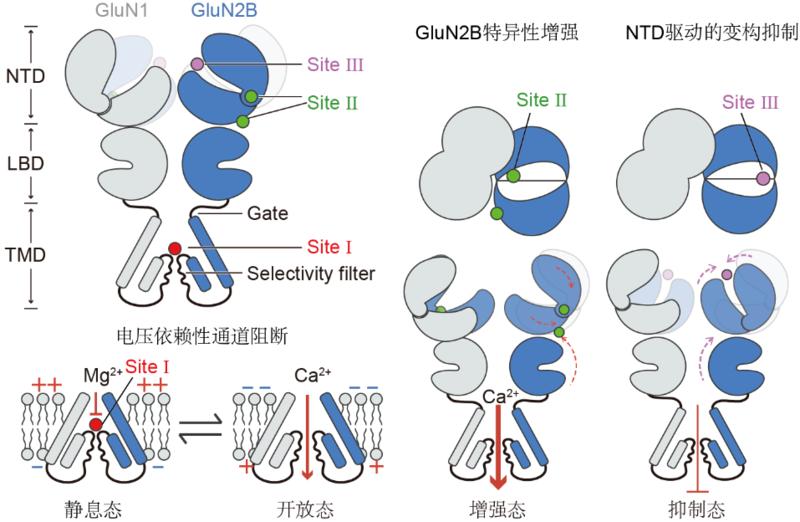
图1. Mg2+作用于GluN1-N2B受体的示意图。位点Ⅰ位于TMD区域内选择性滤器的顶端,在静息膜电位下被Mg2+阻断。这种阻断在膜去极化时得到解除,从而允许Ca2+流入神经元。位点Ⅱ和位点Ⅲ分别位于GluN2B-NTD的两侧,位点Ⅱ参与GluN2B-NTD驱动的变构增强,而位点Ⅲ参与变构抑制作用。
福建医科大学与中国科学院脑科学与智能技术卓越创新中心于2020年启动联合培养项目,旨在共同培养具备科研创新与转化能力的高素质、高层次生物医学博士研究生。该项目采用“基础-临床”协同培养模式,自启动以来已招收16名硕士研究生和4名博士研究生并取得了显著成果。研究生们以第一作者或共同第一作者身份在国内外核心期刊发表了5篇高质量学术论文。其中一人荣获2023年度中国科学院上海分院“中银-科苑优秀学子”奖。研究生们积极参与国内外学术会议,获得"CSH-Asia Conference: Alzheimer's Disease "海报奖学金(全场唯一)以及脑智中心2024年度学术年会海报优胜奖。此外,研究生们还积极投身科普公益活动,连续多年担任脑科学科普夏令营志愿者。这种"基础-临床"协同培养模式积极响应了国家"新医科"建设和"六卓越一拔尖"计划的要求,为医学创新型复合人才的培养提供了成功范例。
上拉加载...